近日,我校化学学院杨荣华教授和卿志和副教授在细胞内信号放大成像分析方面取得重要进展,相关研究成果“Intramolecular catalytic hairpin assembly on DNA tetrahedron for mRNA imaging in living cells: improving reaction kinetics and signal stability”于2019年12月18日在线发表于英国皇家化学会(RSC)《Chemical Science》杂志: Chem. Sci., 2020, DOI: 10.1039/C9SC04916A.
细胞是组成生命体的基本单元,细胞内生化物质(核酸、蛋白质、活性小分子)的表达失调往往与疾病密切相关,包括癌症、神经性疾病、糖尿病等重大疾病。准确获取细胞成分信息是研究细胞生命状态、活动功能和病理变化的关键,而发展有效的分析检测技术是实现生化信息准确获取的基础。一些重要细胞成分通常含量低(nM水平或更低),难以通过常规的方法进行检测,信号放大技术显得尤为重要,例如针对核酸信号放大的PCR等酶促放大技术。PCR等酶促放大技术为低丰度标记物检测提供了重要手段,但往往依赖于热循环过程、蛋白酶的使用、精密控温装置等条件,将放大反应局限于缓冲液、细胞裂解液或死细胞。生命物质处于动态变化中,细胞生命状态的变化会导致细胞成分含量、构型、活性的变化。所以,离体的分析技术难以反映最真实的生命状态,发展细胞内信号放大技术尤为重要。
基于DNA动态自组装的免酶等温放大技术(Dynamic DNA Self-Assembly, DDSA)为实现细胞内原位信号放大、活细胞状态获取信息提供可能,并且多种相关方法已在国际权威期刊被报道。但是,我们发现,用于细胞内放大检测的DDSA方法的反应过程主要依赖游离探针分子间的反应,这样反应速度慢,尤其在低探针浓度下,分析时间长(free catalytic hairpin assembly,free-CHA);另外,反应产物往往呈分子状态,容易受到酶切等生物干扰。如何提高反应动力学和成像信号稳定性是活细胞信号放大技术所面临的挑战之一。
为了解决面临的挑战,在前期研究的基础上(Angew. Chem. Int. Ed. 2019, 58, 11574-11585; Anal. Chem. 2016, 88, 9285-9292; Anal. Chem. 2014, 86, 4934-4939; Chem. Soc. Rev. 2015, 44, 3036-3055; ACS nano 2013, 7, 6545-6554),长沙理工大学化学与食品工程学院杨荣华教授课题组基于限域效应和DNA四面体纳米结构及抗酶切优势,设计和构建了分子内自组装技术用于提高放大反应动力学,并提高信号稳定性(intramolecular catalytic hairpin assembly,intra-CHA,如图1所示)。该工作以肿瘤分子标记物MnSOD mRNA为分析对象,设计和编码核酸探针,通过理论推算和实验验证,结果表明,两探针之间的距离明显缩小,局部浓度得到显著性提升,反应初速度提高15.6倍,同时,相比于free-CHA,intra-CHA的信号稳定性得到明显提升,有促于细胞内信息的准确获取。通过识别单元序列的调整,intra-CHA可适用于细胞内多种物质的信息获取。
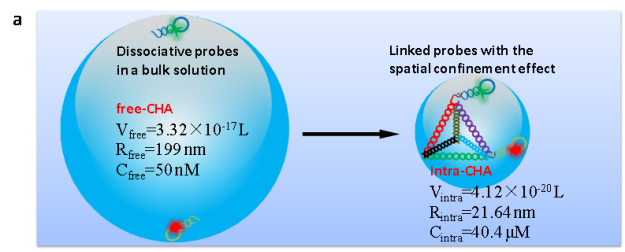
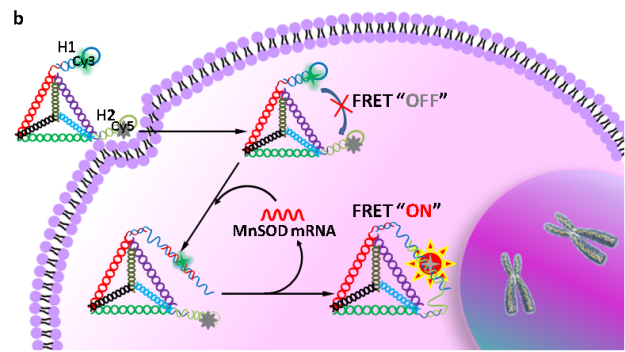
图1:(b) 根据碰撞效率理论,intra-CHA和free-CHA探针理化参数的推算;(b) intra-CHA探针对细胞内mRNA的原位信号放大成像过程示意图.
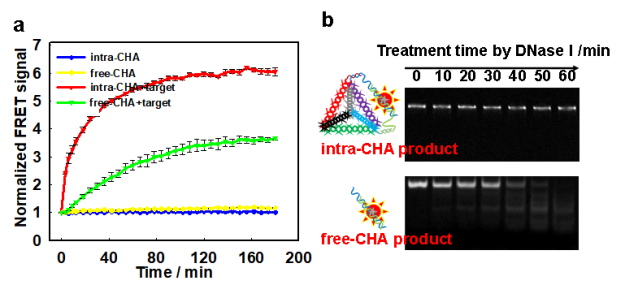
图2:(a) 不同CHA体系下的实时荧光监测;(b)不同CHA产物抗酶切过程的电泳标准。
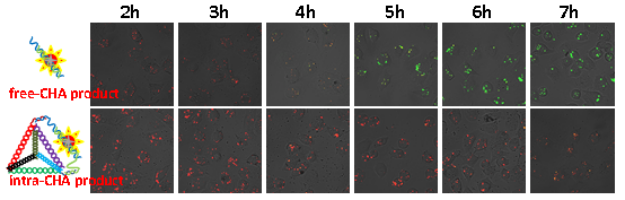
图3:不同CHA产物在活细胞内的信号变化,intra-CHA具有更好的信号稳定性。
该项工作实验部分主要由化学与食品工程学院硕士研究生胡金蕾、许景远完成。研究工作得到了国家自然科学基金、湖南省自然科学基金等项目的支持。全文链接:
https://pubs.rsc.org/en/content/articlelanding/2020/sc/c9sc04916a#!divAbstract。
(文\林朝晖 图\卿志和)

